Tìm thuốc chữa ung thư từ tế bào chết?
- Thực dưỡng chữa ung thư: Cẩn thận tránh tiền mất, tật mang
- Iran sản xuất thuốc chữa ung thư hiệu quả cao
- Sự thật về "thần dược" nano vàng chữa ung thư
Kết quả nghiên cứu thú vị này đã mở ra ý tưởng mới đầy tiềm năng, cho phép ứng dụng với những phương pháp chữa trị hiện nay nhằm nâng cao sức đề kháng của cơ thể chống lại các tế bào ung thư chết người.
Phát hiện độc đáo
Mỗi ngày, hàng tỉ tế bào trong cơ thể người lặng lẽ ra đi vì cơ chế không thể đảo ngược, tạm gọi là “tự sát trong thầm lặng”. Thế nhưng, có những tế bào, khi bị nhiễm bệnh bởi virus hay các tác nhân đột biến, sẽ dần chết mòn vì sự tấn công của các tế bào trong hệ miễn dịch.
Vì vậy, các nhà nghiên cứu từ lâu đã tìm cách để thúc đẩy các tế bào ung thư tự hủy hoặc để hệ thống miễn dịch của bệnh nhân chủ động tấn công chúng, trong bối cảnh các biện pháp hóa - xạ trị thường gây ra các tác dụng phụ ngoài mong muốn như tiêu diệt nhầm các tế bào khỏe mạnh cùng với tế bào ung thư. Họ không ngừng đặt câu hỏi: liệu có thể kích thích hệ miễn dịch, gia tăng các tế bào tiêu diệt ung thư nhờ vào một cơ chế nào đó mà vẫn đảm bảo an toàn cho các tế bào khác?
Trong một số thí nghiệm, các tế bào ung thư hắc tố hoặc ung thư phổi được đưa vào cơ thể chuột để tạo môi trường phát bệnh. Tiếp đó, các nhà khoa học đã kích hoạt thành công RIPK3, vốn chứa loại enzyme kinase (có vai trò chuyển hóa các gốc phosphate từ các phân tử giàu năng lượng sang một phân tử đích cụ thể), sau đó tiêm chúng vào các khối u để tế bào bệnh dần chết trước khi đưa vào cơ thể chuột.
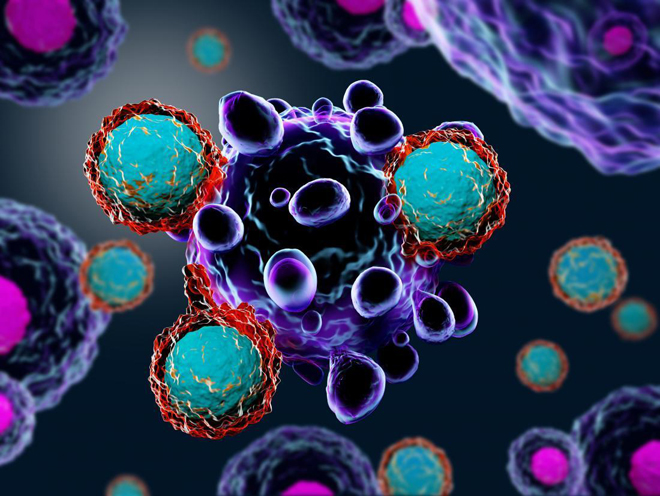 |
| Bằng cách tiêm các tế bào đang “hấp hối” vào khối u, các nhà khoa học đã đánh thức hệ miễn dịch của chuột tấn công lại các tế bào ung thư. |
Bằng cách tiêm các tế bào ung thư đang “hấp hối” đã được biến đổi gen cùng nhóm bệnh vào chuột sau vài tuần, các nhà khoa học đã phát hiện cơ chế “hoại tử theo lập trình” đầy bí ẩn. Khi đó, các tế bào chết đã kích hoạt hệ thống miễn dịch, tăng cường các tế bào T tấn công các tế bào bệnh, làm chậm lại tốc độ phát triển của khối u.
Thí nghiệm độc đáo này sử dụng các tế bào bệnh tiêm dưới da trên chuột để nghiên cứu tác động của hệ miễn dịch với các tác nhân xâm nhập từ bên ngoài, đồng thời đánh giá cơ chế “hoại tử theo lập trình” đầy bí ẩn ở môi trường xung quanh tế bào bệnh.
Điều gây kinh ngạc nằm ở chỗ số lượng tế bào ung thư cũng sụt giảm nhanh chóng khi thay thế các tế bào ung thư đang “hấp hối” nêu trên bởi những nguyên bào sợi trong cấu trúc tế bào, cho dù các sợi này hoàn toàn không mang theo kháng nguyên được tìm thấy trong tế bào ung thư đang “hấp hối”.
Trong khi đó, các kết quả khác cũng cho thấy, một số con chuột nhận các tế bào đang chết mang khả năng “hoại tử theo lập trình” đã sống lâu hơn những con chỉ nhận các tế bào có chứa enzyme kích hoạt cơ chế “tự sát” thông thường.
Ngoài việc tiêm các tế bào “hấp hối” vào khối u, nhiều nhà khoa học đã phát triển một cách khác để có thể kích hoạt cơ chế hoại tử. Họ đã thử nghiệm với virus biến đổi gen, có chứa RIPK3 (mang nhiệm vụ ra tín hiệu cho quy trình hoại tử) có thể hoạt động đến khi tế bào mục tiêu chết hoàn toàn.
RIPK3 được biến đổi phù hợp, tạo nên một hợp chất xúc tác quan trọng, trước khi được tiêm vào virus và trở thành “quả bom nổ chậm”. Quả bom này sau đó được gắn với AAV - những ứng viên thích hợp cho vận chuyển gen nhờ tính an toàn và sản xuất vector vận chuyển khá dễ - để đến được các khối u mục tiêu.
Kết quả thí nghiệm cho thấy các quả bom sau khi “nổ” đã kích thích hệ miễn dịch tạo ra nhiều tế bào tiêu diệt ung thư. Trong thí nghiệm với tế bào ung thư hắc tố, loại virus này hoạt động tương đối trơn tru.
Thậm chí, khi kết hợp loại virus này với một liệu pháp ung thư có tên là phong tỏa điểm kiểm soát thì hiệu quả tiêu diệt tế bào ung thư đã được kéo dài hơn. Liệu pháp phong tỏa điểm kiểm soát sử dụng thuốc làm từ kháng thể với nhiệm vụ là ngăn chặn PD-1/PD-L1 (tín hiệu do tế bào ung thư tạo ra), nhờ đó tế bào T có thể phát hiện và tiêu diệt tế bào ung thư.
Chặng đường còn dài
Cho đến nay, cơ chế “hoại tử theo lập trình” vẫn chưa được giải thích rõ ràng. Nhiều ý kiến suy luận rằng, cơ chế độc đáo đã cô lập các khối u và giúp dẫn dắt các phản ứng miễn dịch.
 |
| Các kết quả nghiên cứu đã tạo tiền đề quan trọng nhằm nâng cao hiệu quả cho liệu pháp miễn dịch ung thư. |
“Hàng rào phòng thủ tự nhiên” chống lại các tế bào ung thư không chỉ được kích hoạt ở các khối u, mà trên khắp cơ thể của chuột. Các tế bào ung thư đã chết tác động lên môi trường xung quanh tế bào ung thư còn sống đã kích thích sản sinh cytokines (do các tế bào miễn dịch như lympho T tạo ra để giao tiếp và vận hành cơ chế đáp ứng miễn dịch) và chemokines (các protein hoạt động trong vai trò là các chất trung gian điều hòa giữa các tế bào trong cơ thể).
Từ đây, số lượng thực bào, bao gồm đại thực bào và các tế bào tua, tăng lên, tiêu thụ các chất dinh dưỡng xung quanh tế bào ung thư rất nhanh, đồng thời mở đường cho sự xuất hiện của T-CD8 - những tế bào bạch cầu chuyên tìm kiếm và tiêu diệt các tế bào nhiễm bệnh trong cơ thể.
Điều khiến giới nghiên cứu hứng thú đó là các tế bào kích hoạt “hoại tử theo lập trình” hoạt động rất mạnh ở phạm vi gần với khối u, hoàn toàn không ảnh hưởng đến những khu vực không có mầm bệnh. Chúng chỉ cần “mở khóa” các thực bào để phát đi tín hiệu tập hợp các tế bào T đến vị trí mục tiêu làm nhiệm vụ của mình.
Tất nhiên, vẫn còn một chặng đường dài để ứng dụng những kết quả từ phòng thí nghiệm, với các tế bào trong ống nghiệm và trên động vật, lên cơ thể người, và xa hơn nữa, trở thành phương pháp hữu hiệu trong điều trị ung thư.
Kích hoạt cơ chế “hoại tử theo lập trình” là một ý tưởng thú vị, một chiến lược hiệu quả chống đội quân ung thư di căn thay vì sử dụng một số biện pháp cũ liên quan đến cơ chế “tự sát tập thể” của các nhóm tế bào bệnh. Tuy nhiên, nhiều loại ung thư cũng tìm cách biến đổi để vô hiệu hóa liệu pháp hoại tử như ung thư vú và bệnh bạch cầu tuỷ bào cấp tính trong một vài thí nghiệm đã có dấu hiệu “nhờn” với sự hoạt động của RIPK3.
Nhiều thí nghiệm vẫn còn hạn chế, cũng như chỉ ở giai đoạn sơ khai, phụ thuộc phần lớn vào kỹ thuật tiêm tế bào dưới da ở chuột. Kỹ thuật này tương đối phổ biến và cho kết quả nhanh chóng nhưng vô cùng phức tạp, đòi hỏi sự chính xác tuyệt đối.
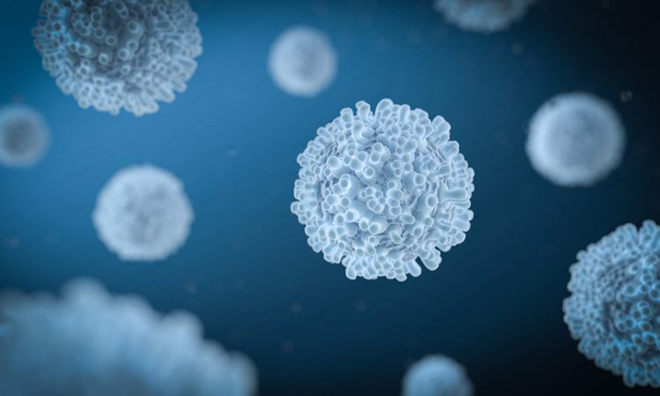 |
| Tế bào T là một loại tế bào lympho (một phân lớp của bạch cầu) đóng vai trò trung tâm trong miễn dịch. |
Nếu muốn tiến được những bước xa hơn nữa thì cần phải làm thí nghiệm với các kỹ thuật khác, đồng thời giải mã cách thức tế bào tạo ra “đội quân” bảo vệ cơ thể trước các tác nhân gây viêm, mối liên hệ thực sự giữa các tế bào chết với RIPK3 và liệu cơ chế “hoại tử theo lập trình” có giống nhau ở các tế bào ung thư khác loại hay không.
Có thể nói, việc sử dụng AAV để trực tiếp đưa RIPK3 đến các tế bào bệnh trên cơ thể chuột nhằm đánh thức “hoại tử theo lập trình” đã mở ra nhiều triển vọng ứng dụng trên cơ thể người ở các bộ phận khác nhau, và hoàn toàn có thể được thực hiện độc lập, không gây tác động đến những khu vực xung quanh.
Tín hiệu khả quan bước đầu chính là sự xuất hiện của cytokines và chemokines, đánh dấu sự hoạt động mạnh mẽ của hệ miễn dịch. Điều băn khoăn hiện giờ chính là, liệu loại virus biến đổi gen này có gây ra phản ứng nhiễm độc nào hay không, và gen bị biến đổi sẽ ảnh hưởng như thế nào ở cấp độ tế bào.
Trong tương lai, các nhà nghiên cứu hy vọng sẽ thử nghiệm trên chuột với các loại khối u gần giống với các căn bệnh ung thư gặp ở người. Bên cạnh đó, họ đã lên ý tưởng tìm cách đưa trực tiếp RIPK3 vào tế bào ung thư, kích thích tất cả mọi tế bào (kể cả đã mất khả năng sản xuất enzyme và hợp chất cần thiết cho quá trình hoại tử) tạo ra cytokines và chemokines.
Chưa hết, một số tham vọng muốn tìm thêm những cách kích thích khác để chính các tế bào ung thư tạo ra một loại enzyme thúc đẩy quá trình “tự sát” khiến các khối u teo dần tới chết. Đây được coi là những tiền đề quan trọng nâng cao hiệu quả cho liệu pháp miễn dịch ung thư khi cuộc chiến với căn bệnh hiểm nghèo này vẫn còn nhiều khó khăn.
