Đột phá trong cuộc chiến chống ung thư loài người
- Cà chua có khả năng phòng chống ung thư
- Virus biến đổi gene chống ung thư
- Gien chống ung thư có thể làm chậm lão hóa
Phát hiện này tiếp tục mở ra những hi vọng mới về phương pháp và lộ trình điều trị ung thư của nhân loại, từ đó góp phần kéo dài sự sống cho bệnh nhân cũng như tiến tới xóa sổ căn bệnh hiểm nghèo này.
Liệu pháp miễn dịch
Do bị đột biến nên các tế bào ung thư trở nên bất thường, nhân lên mạnh mẽ không tuân theo bất cứ một quy luật nào, đồng thời sẵn sàng “du lịch” tới các nội quan của cơ thể để phá hủy hoạt động của chúng.
Hệ thống miễn dịch thường phát hiện và tiêu diệt các tế bào đột biến, nhưng các tế bào ung thư lại tìm ra những cách phức tạp hơn để “trốn” khỏi các cuộc tấn công miễn dịch như đẩy mạnh một cơ chế phanh - kiểm soát các tế bào miễn dịch, nhờ đó tiếp tục phát triển.
Trên thực tế, đã có nhiều liệu pháp điều trị ung thư được nghiên cứu và thử nghiệm. Tuy nhiên, việc điều trị gặp phải rất nhiều khó khăn vì ngay cả những liệu pháp thông thường giúp tiêu diệt các tế bào ung thư cũng làm tổn thương các tế bào khỏe mạnh.
 |
| Giải thưởng Nobel Y học 2018 đã được trao cho nhà khoa học Mỹ James Aliison và nhà khoa học Nhật Bản Tasuku Honjo với những nghiên cứu về liệu pháp khai thác hệ miễn dịch để tấn công các tế bào ung thư. |
Nhận thức được vấn đề này, giới khoa học đã hướng mũi nhọn chiến lược điều trị ung thư vào hệ miễn dịch. Trong nghiên cứu của mình, Giáo sư Allison đã phát hiện protein CTLA-4 trên bề mặt tế bào miễn dịch T.
Khi được kích hoạt, CTLA-4 có thể ức chế đáp ứng miễn dịch, vì vậy ông sử dụng một kháng thể kháng CTLA-4 gắn với protetin này cho phép tế bào T tiếp tục tiêu diệt tế bào ung thư. Với thí nghiệm trên chuột, ông nhận thấy khi chuột bị ung thư được điều trị bằng kháng thể ức chế CTLA-4, chúng sẽ được chữa lành.
Từ đây, giáo sư đề xuất việc đưa chất ức chế protein này vào sản xuất thuốc điều trị bệnh ung thư. Đây được xem là một loại thuốc đột phá vì đã chuyển bệnh ung thư nguy hiểm có thể giết chết người trong vài tháng thành căn bệnh có thể chữa lành.
Trong một nghiên cứu độc lập với nhà khoa học Mỹ, Giáo sư Honjo phát hiện PD-1 - protein ở tế bào miễn dịch - hoạt động như chất ức chế tế bào ung thư, nhưng thông qua một cơ chế miễn dịch khác với CTLA-4.
Những loại thuốc liên quan đến PD-1 như pembrolizumab và nivolumab được sử dụng để điều trị u hắc tố khi chúng ngăn chặn protein PD-1 trên bề mặt tế bào miễn dịch T, dẫn đến kết quả là những tế bào này tấn công khối u.
Giáo sư Honjo đã mở một lộ trình điều trị ung thư mới bằng cách kiểm soát chức năng của protein để điều chỉnh khả năng miễn dịch, dẫn tới sự phát triển của Opdivo - một loại thuốc chống ung thư phổi.
Theo kết quả thử nghiệm, loại thuốc mới này đem lại nhiều tín hiệu tích cực. Hai tháng sau khi đưa vào tế bào miễn dịch, hiện tượng tiến triển giả xuất hiện, và sau bốn tháng thì kích thước khối u đã thu nhỏ.
Liệu pháp siêu nhỏ
Bên cạnh công nghệ miễn dịch, giới khoa học cũng đạt được những thành công đáng kể trong lĩnh vực nano về ung thư.
Hiện nay, các nhà khoa học Mỹ đã bắt tay chế tạo các robot siêu nhỏ (nanobot) nhằm “truy tìm” các khối u và cắt đứt nguồn cung cấp máu đến các vùng bị tổn thương, trong khi hoàn toàn không gây ảnh hưởng đến các tế bào khỏe mạnh bên cạnh.
Các nanobot được trang bị enzyme thrombin có vai trò làm đông máu, mang theo một đoạn ADN hoặc ARN hoặc peptide có khả năng liên kết với một phân tử đích một cách đặc hiệu với áp lực cao.
Chúng nhắm đến nucleolin - loại protein được tìm thấy với số lượng rất lớn ở các tế bào ung thư. Sau khi xác định vị trí và gắn kết với bề mặt mạch máu khối u, các nanobot được kích hoạt và đưa vào thrombin, gây ra hiện tượng đông máu trong các mạch máu có vai trò làm tăng kích thước khối u, cắt đứt nguồn cấp máu và tiêu diệt các mô của khối u một cách nhanh chóng.
Tại Canada, nhiều nhóm nghiên cứu đang phát triển một loại nanabot sinh học có thể tự động phát hiện khu vực tế bào ung thư đang phát triển thông qua cơ chế đặc biệt “vùng thiếu oxy” do các tế bào ung thư phát triển thường tiêu thụ oxy quá mức.
Trên thực tế, những quân đoàn nanobot bao gồm hơn 100 triệu vi khuẩn roi nạp đầy thuốc. Chúng di chuyển theo con đường ngắn nhất giữa điểm tiêm thuốc tới khu vực bị bệnh dựa trên “la bàn” được tạo ra bằng cách tổng hợp chuỗi hạt nano từ, cho phép chúng di chuyển theo hướng của từ trường điều khiển bằng máy tính.
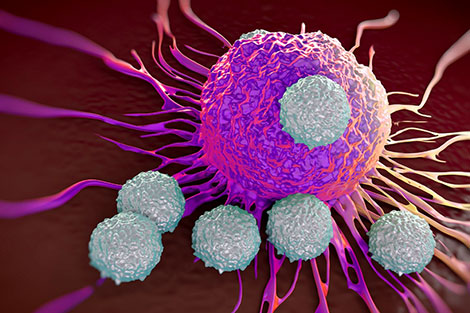 |
| Trong thí nghiệm, khi chuột bị ung thư được điều trị bằng kháng thể ức chế CTLA-4, chúng sẽ được chữa lành. |
Điểm độc đáo là nanabot phát hiện những nơi cạn kiệt oxy nhờ cảm biến đo nồng độ oxy, và mang thuốc tới đúng địa chỉ trong bối cảnh “vùng thiếu oxy” không thể tiếp cận và điều trị bằng phương pháp thông thường hiện nay.
Trong khi đó, các nhà nghiên cứu Hà Lan đã phát triển hệ thống “túi” siêu nhỏ, được đưa vào cơ thể từ vùng lân cận của tế bào ung thư, và phản ứng với một số chất hóa học để tìm đến tế bào gây bệnh.
Hệ thống này hoạt động như tàu ngầm thu nhỏ, tự vận hành nhờ động cơ hóa học sử dụng nhiên liệu là axit yếu hydro peroxyt. Khi hydro peroxyt phân tách, “túi” di chuyển về phía trước, xuyên qua thành tế bào ung thư và tự phân hủy để giải phóng thuốc tiêu diệt tế bào bệnh.
Cơ chế tự giải phóng thuốc không cần tác động từ bên ngoài diễn ra khi glutathione - tác nhân hóa học thường được tìm thấy với mật độ cao trong các tế bào ung thư - phản ứng với một chất giữ thuốc bên trong “túi”, phá vỡ các liên kết cộng hóa trị là cầu disulfideS-S, giúp thuốc được giải phóng ra ngoài.
Một số chuyên gia nhận định, liệu pháp siêu nhỏ dường như nhanh và chính xác hơn, đồng thời bảo vệ được các tế bào khỏe mạnh. Các nanorobot hay “túi” siêu nhỏ đều an toàn, không có bằng chứng cho thấy chúng ảnh hưởng đến hệ thần kinh khi thoát ra khỏi cơ thể sau 24 giờ.
Đây được coi là một giải pháp tiềm năng thay thế cho hóa - xạ trị, vốn là những phương pháp điều trị ung thư phổ biến có thể gây tổn hại nghiêm trọng đến mô khỏe mạnh.
Bên cạnh đó, kỹ thuật mới có thể giúp các bác sĩ đưa thuốc đến chính xác vị trí mong muốn trên cơ thể người bệnh, giúp bệnh nhân tránh được phẫu thuật cũng như gia tăng hiệu quả tiêu diệt tế bào ung thư.
Liệu pháp… tự sát
Về bản chất, tế bào ung thư rất khó bị tiêu diệt vì có chứa các biến thể gen của chính tế bào bị biến đổi, rất giống với tế bào bình thường, do vậy rất khó để lựa chọn liệu pháp tiêu diệt tế bào ung thư mà không làm hại đến tế bào khỏe mạnh.
Trong bối cảnh này, các nhà khoa học Anh nghĩ tới chiến lược “lập trình để tế bào ung thư tự diệt”, nhờ vậy ngăn được sự di căn ung thư.
Trong phòng thí nghiệm, họ đang cố gắng sử dụng công cụ chỉnh sửa gen CRISPR đưa protein TRAIL vào trong tế bào bạch cầu, thông qua máu, rồi đến tế bào ung thư. Protein TRAIL kích hoạt bộ máy của tế bào, khiến các tế bào ung thư tự động “chết” mà không gây hại cho các tế bào khỏe mạnh.
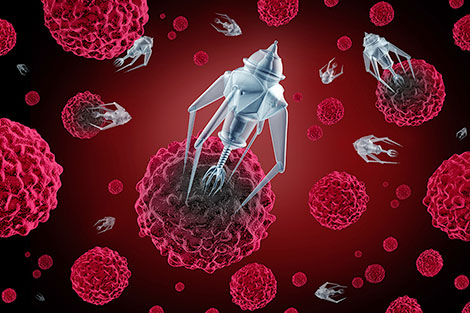 |
| Liệu pháp siêu nhỏ dường như nhanh và chính xác hơn, đồng thời bảo vệ được các tế bào khỏe mạnh, là một giải pháp tiềm năng thay thế cho hóa - xạ trị. |
Thí nghiệm được tiến hành trên các mẫu chuột bị u não nguyên phát, u não tái phát và ung thư vú đã di căn lên não. Kết quả cho thấy, “tế bào sát thủ” TRAIL không những thu nhỏ kích thước khối u một cách đáng kể mà còn làm tăng khả năng sống của chuột. Tuy nhiên, TRAIL vẫn chưa được áp dụng nhiều trong lâm sàng bởi vì thời gian sống ngắn ngủi.
Sau khi nhận được tỉ lệ thành công là 60% trong thí nghiệm với chuột, thử thách bây giờ là chứng minh liệu pháp đó hoạt động an toàn trên những động vật lớn hơn, bao gồm cả con người.
Trong một nghiên cứu khác, nhóm chuyên gia đến từ Đại học Tel Aviv (Israel) đã tiết lộ vai trò của một số loại protein chuyên biệt có trong tế bào ung thư đang nhân bản khi chúng phân bào.
Theo đó, các protein này tác động đến cấu trúc và sự ổn định của một bộ phận trong tế bào ung thư có tên “trục chính” - cấu trúc vi quản hình thoi có chức năng chuẩn bị nhân đôi nhiễm sắc thể trong quá trình phân chia thành những tế bào con.
Các nhà khoa học phát hiện hợp chất Phenanthridine có thể làm giảm hoạt động của những protein này, dẫn đến cấu trúc trục của tế bào ung thư bị vặn vẹo, khiến quá trình phân chia nhiễm sắc thể không thể diễn ra. Nhóm nghiên cứu Israel dự kiến nghiên cứu sâu hơn về cơ chế biến đổi protein giúp chống lại ung thư, đồng thời tìm tòi phát triển một loại thuốc đặc hiệu dựa vào cơ chế độc đáo này.
Họ tin rằng, nhờ Phenanthridine, tế bào phân chia càng nhanh lại càng bị hủy diệt nhanh. Sớm hay muộn, toàn bộ tế bào ung thư sẽ bị tiêu diệt.
